Кислород — один из самых распространенных химических элементов в природе. Реакция восстановления кислорода является основой биоэнергетики всех аэробных форм жизни.
Молекулярный кислород (О2) крайне необходим для обеспечения жизнедеятельности организма, однако сам по себе он обычно не вступает в неконтролируемые химические реакции внутри организма, для его активации нужны ферментативные процессы.
Главными ферментами метаболизма кислорода у млекопитающих являются оксидазы и оксигеназы, в каталитических центрах которых кислород испытывает превращения до конечных соединений, при этом не выделяясь в среду и не подвергая опасности органические макромолекулы клетки.
Повреждающими агентами организма являются активные формы кислорода (АФК).
Что такое АФК?
Существенное количество употребляемого человеком молекулярного кислорода принимает участие в реакциях окисления, в ходе которых к молекуле О2 происходит синхронная транспозиция четырех свободных электронов с последующим образованием двух молекул воды или подобных соединений. Дальнейшие реакции одноэлектронного восстановления, непрерывно протекающие во всех живых организмах, приводят к формированию промежуточных продуктов восстановления молекулы кислорода - активных форм кислорода (АФК), общим характерным свойством которых является высокая реакционная способность при весьма короткой продолжительности жизни.
В организмах существуют различные механизмы активации О2, посредством которых образуется гетерогенный по своим физикохимическим свойствам класс АФК. Выделяют производные кислорода радикальной (свободные радикалы) и нерадикальной природы.
АФК радикальной природы (свободные радикалы)
Это молекулы, содержащие один или более неспаренных электронов, которые придают молекуле реакционную способность:
– супероксидный анион-радикал (О2•–);
– гидропероксил радикал (НО2•);
– гидроксил радикал (ОН•);
– реактивные виды азота, хлора и брома.
АФК нерадикальной природы
Образуются, когда 2 свободных радикала разделяют свои неспаренные электроны:
– пероксид водорода (Н2О2);
– синглетный кислород (1О2).
Основные АФК
Супероксидный анион-радикал (О2•–)
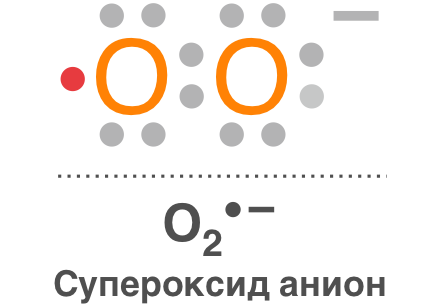
Является продуктом одноэлектронного восстановления О2 и практически не проникает через биомембраны. Время его жизни 3–4 мкс, радиус распространения около 30 нм при нейтральных значениях pН.
Основными источниками О2•– являются митохондриальная цепь переноса электронов и мембраносвязанная NOX, а также супероксиддисмутазы, каталитический цикл цитохрома, митохондриальные ферменты (глицерол3-фосфатдегидрогеназа, 2 оксоглутаратдегидрогеназа, NADH-цитохром b5 редуктаза и др.), ксантиноксидоредуктаза.
Разнообразные гормоны, включая факторы роста (тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), инсулин и IGF) и цитокины (ФНО-α и ангиотензин II) могут стимулировать выработку NADPH-оксидазами неиммунных клеток, образованный NOX, затем быстро превращается в H2O2 с помощью SOD.
Митохондриальный О2•– участвует в таких процессах, как:
1) инактивация митохондриальной аконитазы (редокс-регулируемый фермент цикла Кребса) посредством разрушения железо-серного кластера данного фермента;
2) индукция митохондриального перекисного окисления липидов (данный процесс происходит после реакций Н2О2 с цитохромом, что в свою очередь приводит к цитозольному высвобождению проапоптотических факторов).
После синтеза О2•– подвергается либо быстрой детоксикации с помощью митохондриальной MnSOD (Mn-зависимой супероксиддисмутазы), либо транспорту через митохондриальную мембрану, при этом супероксид проходит через вольтаж-зависимый анионный канал (митохондриальный порин).
Гидропероксил радикал (НО2•)

Является протонированной формой супероксида с формулой HO2.
HO2• образуется в результате переноса атома водорода на молекулу кислорода, путём взаимодействия атома кислорода с гидроксильным радикалом (HO•) или протона с супероксид анионом.
В ходе многих биологически важных реакций HO2• может вести себя как окислитель, отбирая атомы водорода от токоферола и полиненасышенных жирных кислот липидной мембраны. По этой причине он является одним из основных инициаторов перекисного окисления липидов.
Гидроксил радикал (•ОН)

Наиболее мощный и агрессивный окислительный радикал, ответственный за повреждение большинства биомолекул, биологическая роль которого пока неизвестна.
•ОН образуется в результатевзаимодействия О2– и Н2О2 при наличии ионов железа (Fe2+, Fe3+) или меди (Cu2+). Имеются сведения о генерации •ОН при взаимодействии Н2О2 с ферредоксином и убихиноном, а также в результате радиолиза воды.
Вследствие высокой реакционной способности •ОН мгновенно взаимодействует с близлежащими молекулами, однако имеет очень короткое время жизни (10–9 с) и не диффундирует далеко от места образования. •ОН повреждает липиды, белки, нуклеиновые кислоты и оказывает цитотоксическое действие.
Пероксид (перекись) водорода Н2О2

Является основным видом АФК, образующимся в качестве побочного продукта во время разнообразных клеточных процессов и являющимся конечным продуктом многочисленных метаболических реакций.
Молекулы Н2О2 отличаются продолжительным временем жизни (1 мс) и способны распространяться на значительные расстояния (до 1 мкм) в водных растворах.
В низких концентрациях молекулы Н2О2 выполняют важные функции, что позволяет рассматривать их как внутриклеточные мессенджеры, однако, в высоких концентрациях (1–50 мМ) токсичны для большинства живых клеток.
H2O2 является сильным двухэлектронным окислителем - более сильным, чем хлорноватистая кислота или пероксинитрит, но в отличие от этих высокореактивных веществ H2O2 имеет высокий энергетический барьер активации, который необходимо преодолеть для проявления окислительной способности. Переходные металлы, такие, как железо(II) и медь(I), могут расщеплять связь O–O H2O2 с образованием гидроксильных радикалов или комплексных соединений с металлом.
Н2О2 является продуктом таких многочисленных метаболических процессов, как спонтанная дисмутация супероксидных радикалов, катаболизм полиаминов, тимидина, каталитический цикл цитохрома, работой таких ферментов, как NOXs, моноаминоксидазы, лизилоксидазы, дигидрооротатдегидрогеназа, пероксисомальные ферменты (ацил-КоА-оксидазы, d-аминокислотная оксидаза, d-аспартат-оксидаза и др.), система микросомальной монооксигеназы, фолдинг белков (ответ развернутого белка), метаболизм полиненасыщенных жирных кислот.
Н2О2 способна участвовать в таких окислительных процессах, как деградация гемовых белков, выделение железа, инактивация ферментов и окисление ДНК, липидов, селенопротеинов, тиоловых групп и кетокислот.
Синглетный кислород 1О2
Представляет собой электронно-возбуждённое состояние молекулярного О2 и является мощным окислителем, быстро реагирующим с макромолекулами. Высоко реактивная природа 1O2 в живых клетках обусловлена периодом полураспада, от 0,2 до 3,9 мкс. Радиус его распространения варьирует в пределах 30–190 нм.
1O2 генерируется в реакциях сенсибилизации при освещении определённых молекул светом.
Под действием солнечного света происходит генерация окислителей электронным возбуждением. Фотовозбуждение эндогенных или экзогенных молекул сенсибилизатора (фотосенсибилизация) приводит к образованию реакционноспособных частиц, в частности синглетного молекулярного кислорода, электронно-возбужденных карбонилов и супероксидных анионных радикалов; это может вызвать молекулярное повреждение. Волнами, имеющими биологическое значение, являются ультрафиолетовое бета-излучение (290–320 нм) и ультрафиолетовое альфа-излучение (320–400 нм). Известно, что видимый свет и даже инфракрасное альфа-излучение вызывают фотобиологические реакции.
Синглетный кислород опосредует общую делецию митохондрий (образуются мутации в ДНК митохондрий), связанную с фотостарением.
С точки зрения здоровья человека, наиболее подвержены воздействию ультрафиолета такие ткани, как кожа и глаза.
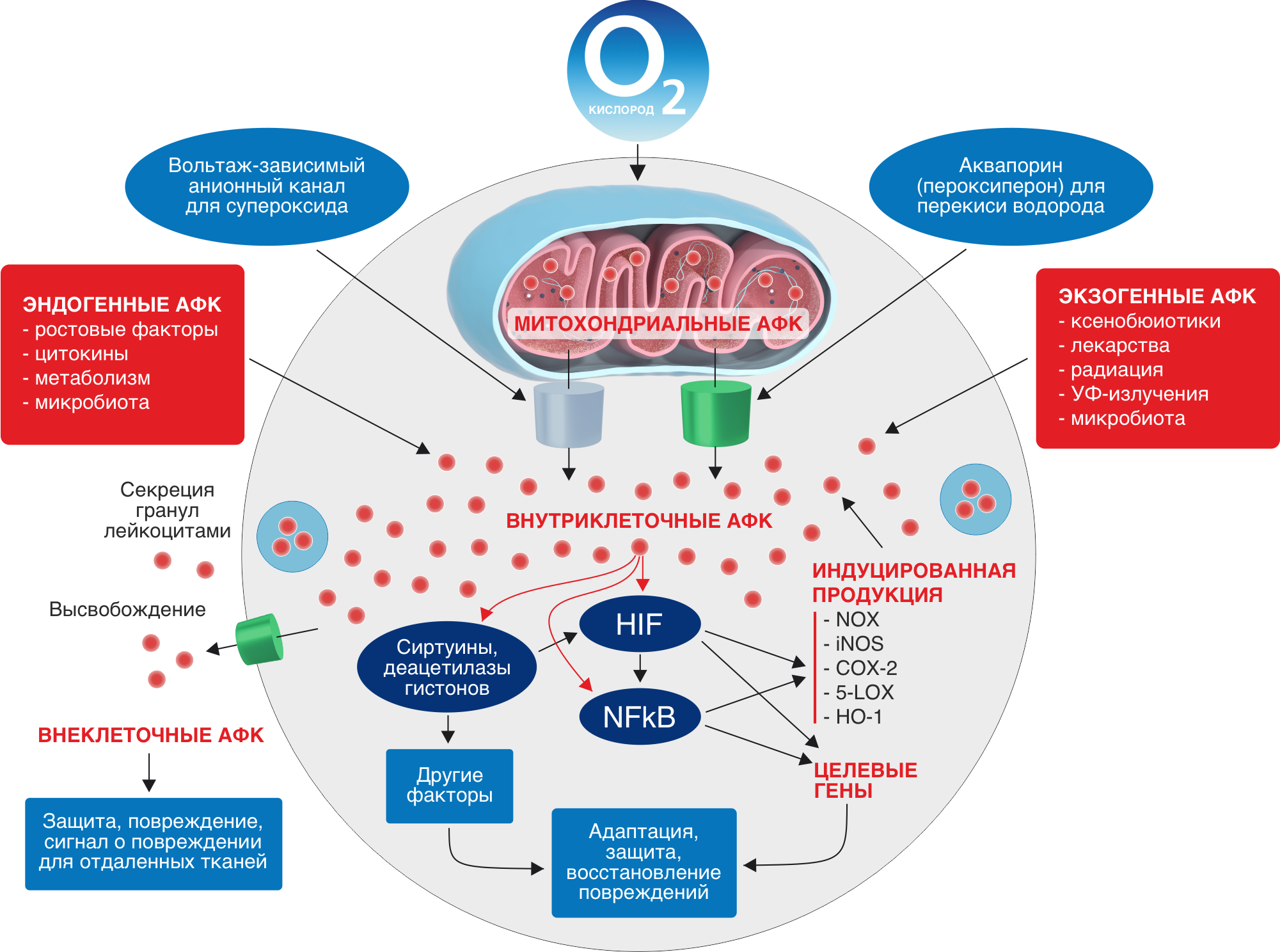
Источники АФК
АФК постоянно генерируются в электрон-транспортной цепи (ЭТЦ) митохондрий и хлоропластов, образуются в содержащих редокс-системы мембранах и разных компартментах клетки как побочный продукт метаболических путей, когда наши клетки вырабатывают энергию из пищи, а также когда мы подвергаемся воздействию бактериальных и вирусных инфекций, интенсивных физических нагрузок, ксенобиотиков, сигаретного дыма, алкоголя, ионизирующего и ультрафиолетового излучений, пестицидов, озона и других видов агрессивного воздействия.
АФК сконцентрированы практически во всех внутри- и внеклеточных структурах и жидкостях: в митохондриях, цитозоле, одиночных мембраносвязанных органеллах (пероксисомах, эндосомах и фагосомах), экзосомах, высвобождаемых плазматическими мембранами, и внеклеточных жидкостях, включая плазму.
Наиболее важными источниками АФК являются митохондрии ввиду происходящего в них процесса переноса электронов по цепи переноса электронов и наиболее важных биохимических реакций.
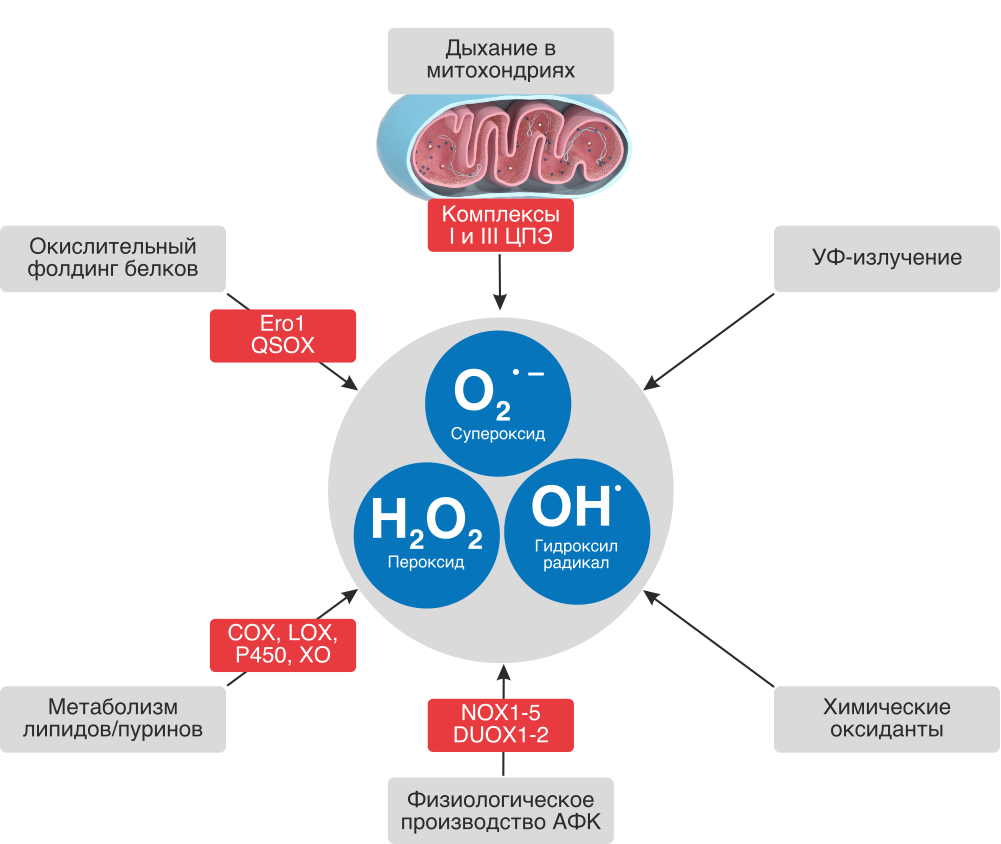
Основные источники АФК в организме
Функции АФК
Высокая реакционная способность и малое время жизни в биологических системах позволяет АФК участвовать в клеточном сигналинге – передаче информации на короткие расстояния. Сигнальная функция АФК может осуществляться с помощью редокс чувствительных белков (глутатион, тириодоксин), путём мобилизации ионов кальция, регуляции фосфорилирования/дефосфорилирования сигнальных белков, через регуляцию уровня гормонов, редокссостояния клетки и другие механизмы.
Обнаружено множество физиологических эффектов АФК. АФК индуцируют транскрипцию различных генов и/или факторов транскрипции, участвуют в пролиферации клеток, внутриклеточной коммуникации и межклеточной сигнализации.
АФК участвуют в трансдукции сигналов, инициирующих программируемую клеточную смерть (ПКС). Считается, что сигнал ПКС передаётся в митохондрии и вызывает повышение генерации АФК. АФК нарушают целостность мембран, провоцируют образование в них пор, через которые в цитозоль выходят факторы, активирующие протеазы (каспазы), разрушающие цитозольные белки и эндонуклеазы, разрушающие ядерную ДНК. С помощью ПКС многоклеточные организмы избавляются от нежелательных или лишних клеток, функции которых являются временными. Одна из форм ПКС – апоптоз – удаляет ослабленные, повреждённые и ненужные клетки. В организме человека апоптозу ежедневно подвергаются 5–7% клеток.
Способность клеток генерировать АФК в значительных количествах играет важную роль в защите от бактериальной и вирусной инфекции.